Existen multitud de fijadores en los manuales de técnicas histológicas. Aquí sólo trataremos aquellos que consideramos de uso más común para la observación de tejidos al microscopio, es decir, aquellos que mejor preserven la estructura celular. Los fijadores químicos son los más frecuentemente empleados, bien compuestos por un solo tipo de sustancia fijadora o con mezclas de varias de ellas.
Los fijadores se pueden clasificar en dos grandes grupos según su acción sobre el tejido: los coagulantes y los que establecen enlaces cruzados. Los primeros, al extraer agua de los tejidos producen coagulación y desnaturalización de las proteínas, sobre todo las de la matriz extracelular, mientras que los segundos establecen enlaces químicos entre moléculas del tejido. Los fijadores que tienen como base al alcohol son desnaturalizantes, tales como el Bouin o el Carnoy, mientras que el formaldehído o el glutaraldehído establecen enlaces. También se preparan soluciones mixtas de ambos tipos de fijadores.
Otra clasificación de los fijadores es según sean aditivos o no aditivos. Los primeros tienen moléculas o iones que se combinan con las moléculas del tejido y formarán parte de él en los pasos sucesivos del procesamiento. Estos son sobre todo los que establecen enlaces y algunos coaguladores. Los no aditivos son aquellos que tras llevar a cabo su función son eliminados en pasos posteriores, como es el caso del alcohol o el ácido acético.
¡Atención! La mayoría de las sustancias fijadoras son tóxicas por inhalación o por contacto, algunas de ellas cancerígenas. Hay que seguir las indicaciones de seguridad para su manejo y utilización.
1. Fijadores simples
Etanol, metanol, acetona
El etanol (Figura 1), metanol, acetona fijan por deshidratación y coagulación de las proteínas, sobre todo las citosólicas. Extraen los lípidos de los tejidos, pero no afectan a los carbohidratos. El metanol es mejor fijador que el etanol puesto que no causa tanto endurecimiento del tejido y aporta una mejor preservación. En general, son buenos fijadores de muestras de pequeño tamaño, y preservan bien algunas proteínas como las enzimas, también glucógeno, y pigmentos. Se usan frecuentemente para para fijar las extensiones citológicas o secciones de criostato obtenidas de tejido no fijado. Debido a que deshidratan, a la vez que fijan, se pueden usar también como un conservante de las muestras. Tienen algunos inconvenientes como producir endurecimiento y la retracción de los tejidos, muy evidentes en bloques de tejido muy grandes. Carecen de efecto mordiente.
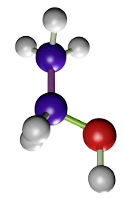
(CH3CH2OH)
Ácido acético
El ácido acético (Figura 2) no fija directamente a las proteínas sino que su proceso de fijación consiste en cambiar el estado coloidal de las proteínas. Se utiliza a una concentración que varía entre el 1 y el 5 %. Es el fijador ideal para ácidos nucleicos y nucleoproteínas. Como inconvenientes cabe destacar la destrucción de las mitocondrias y mala fijación de membranas y citoplasma. Se suele usar en combinación con otros fijadores. Ejemplos: Bouin, FAA (formol, ácido acético y alcohol). En las mezclas de fijadores también es capaz de contrarrestar los artefactos que pueden introducir el etanol o el ácido pícrico.
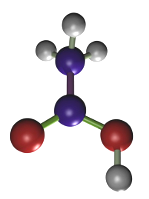
(CH3COOH)
Cloruro o sulfato de zinc
El cloruro de zinc se utilizó inicialmente como fijador único, pero más tarde pasó a ser un componente de mezclas fijadoras. Se emplea normalmente en combinación con el paraformaldehído. El cloruro de zinc ayuda a la fijación y preserva la antigenicidad si se necesita el tejido para pruebas inmunocitoquímicas, ya que contrarresta el enmascaramiento de antígenos que se atribuye al paraformaldehído. Las sales de zinc han sustituido progresivamente a las sales de mercurio usadas tradicionalmente en las mezclas fijadoras. Es importante señalar que el fijador no se prepara en sales de fostato, como es habitual, y tras la fijación ha de eliminarse el zinc mediante lavados en agua destilada.
Ácido pícrico
La fijación por ácido pícrico (Figura 3) se produce gracias a que las sales del tipo picrato coagulan las proteínas de los tejidos. Se suele usar del 2 al 15 % de una solución saturada de ácido pícrico. Preserva bien la estructura celular, no produce retracciones cuando el tiempo de fijación es óptimo, preserva bien glucógeno y lípidos. Es un buen fijador para tinciones generales puesto que tiene efecto mordiente y favorece la unión de algunos colorantes. Hay que eliminarlo completamente antes de proceder a la inclusión en ceras como la parafina puesto que dificulta la penetración de la parafina. Se suele usar combinado con otros fijadores. Ejemplos: Bouin.
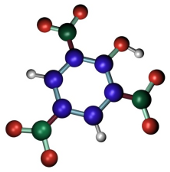
(C6H2OH(NO2)3)
Formaldehído
El formaldehído (Figura 4) es un fijador ampliamente usado por la buena preservación del tejido, actúa como conservante, produce poca retracción tisular, es compatible con la mayoría de las técnicas y tinciones histológicas, incluidas las de inmunocitoquímica e hibridación de ácidos ribonucleicos. El formaldehído se une a grupos funcionales de las proteínas formando grupos hemiacetales (Figura 5). Esta unión hace que muchos enzimas queden inactivas, lo que ayuda a evitar la degradación del tejido por las enzimas hidrolíticas. Los grupos a los que se une son amino, sulfidrilos, guanidilos, grupos hidroxilos alifáticos, etcétera. La unión a uno de estos grupos produce un grupo hidroximetileno. Es el hidroximetileno el que reacciona con grupos de otra, o de la misma proteína para la formación de puentes. El formaldehído preserva bien los lípidos, sobre todo si se añade a la solución fijadora iones de calcio (reducen la solubilidad de los fosfolípidos), y no reacciona con los carbohidratos.
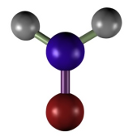
(CH2=O)

La fijación normalmente es de 24 a 50 h, aunque puede ser de 1 a 2 semanas. Si el tejido va destinado a inmunohistoquímica es suficiente con 12-24 h a 4ºC. Fijaciones muy prolongadas endurecen el tejido y pueden provocar inestabilidad de los ácidos nucleicos. Parte del fijador del tejido se puede eliminar mediante lavados prolongados. Normalmente se usa en solución tamponada e isotónica. Se utiliza a concentraciones próximas al 4 %. Actualmente se prepara a partir de paraformaldehído, sustancia sólida. Ejemplos: formaldehído tamponados, Bouin, FAA (formaldehído, ácido acético, alcohol), PLP (paraformaldehído, lisina, ácido peryódico).
Glutaraldehído
El glutaraldehído (Figura 6) es uno de los fijadores más usados. En solución polimeriza formando dímeros y trímeros. Los grupos aldehídos que quedan dentro en la molécula polimerizada reaccionan con los grupos aminos de los aminoácidos de las proteínas, formando puentes entre las moléculas de los tejidos. Los grupos aldehídos de los extremos, sin embargo, quedan libres, y es importante anularlos para evitar falsos positivos (por ejemplo, evitando que se unan los anticuerpos durante la inmunocitoquímica o que se unan los aldheídos del reactivo de Schiff). Por tanto, es una buena práctica eliminarlos, lo que se puede hacer mediante la incubación en borohidruro de sodio al 1 %. El glutaraldehído tiene poca velocidad de penetración, por lo que la fijación por perfusión vascular es recomendada. Se usa a una proporción de entre el 0,5 y el 3 %. Tiene una alta capacidad para preservar la estructura celular puesto que es capaz de entrelazar el tejido más fuertemente que otros aldehídos, por lo que es el fijador de referencia para observación de ultraestructuras celulares con el microscopio electrónico. Sin embargo, no se recomienda para inclusiones en parafina puesto que dificulta la obtención de secciones. Hay que tener cuidado con su baja penetración tisular y puede producir retracciones. Se usa en soluciones tamponadas isotónicas y normalmente en combinación con el formaldehído.

A lo largo de la historia de la histología se han usado otros tipos de aldehídos como fijadores, muchos de los cuales han dejado de usarse. Por ejemplo, el hidrato de cloral para el sistema nervioso, la acroleína, muy tóxico y usado para microscopía electrónica, o el glioxal.
Tetróxido de osmio
El tetróxido de osmio (Figura 7) es uno de los fijadores más antiguos, se usa desde al menos 1865. En solución penetra poco en los bloques de tejido, y se recomiendan tamaños no mayores de 0.5 o 1 mm. Se puede usar tanto en solución como en vapor. No produce artefactos pero hace a las muestras de tejido frágiles. Forma puentes entre los enlaces insaturados de las cadenas de ácidos grasos de los lípidos de las membranas celulares (Figura 8). Las hace insolubles, oscuras y opaca a los electrones. Por eso se emplea habitualmente para las observaciones con el microscopio electrónico, ya que preserva y oscurece las membranas celulares. Pero también se usa en microscopía óptica para estudiar las grasas insaturadas, para observar los tractos de mielina, y es necesario para las impregnaciones argénticas como el método de Golgi. Por su fuerte carácter oxidante no se usa para tinciones convencionales puesto que impide la unión al tejido de los colorantes aniónicos. Actualmente se usa mucho tras la fijación de las muestras con formaldehído o glutaraldehído, y antes de deshidratar dichas muestras, para su observación al microscopio electrónico.


2. Mezclas fijadoras
La mayor parte de los procesos de fijación usan varias sustancias fijadoras, bien mezcladas en la solución acuosa inicial o utilizadas sucesivamente en el tiempo. Con ello se aprovechan las ventajas de cada una de ellas y se pueden contrarrestar sus desventajas. Hay multitud de formas de usar los diferentes fijadores, tanto en sus componentes como en las proporciones de éstos, dependiendo de las necesidades posteriores, es decir, qué tipo de tejido queremos fijar y qué queremos ver de dicho tejido. Junto con las sustancias fijadoras también se añaden a las mezclas otros componentes que afectan a otros parámetros como la osmolaridad o el pH de la solución. Por ejemplo, en la mayoría de los casos las sustancias fijadoras se disuelven en soluciones tamponadas para controlar osmolaridad y pH, de manera que no se afecte a la estructura del tejido. Pero también con otros propósitos, como por ejemplo el etilén glicol que se añade a los fijadores para obtener secciones por congelación y además evita la difusión de las enzimas.
A continuación vamos a mencionar algunas combinaciones usadas frecuentemente porque tienen unas propiedades de fijación que las hace apropiadas para las observación de una gran variedad de tejidos y para el uso de diversas de técnicas de tinción.
Líquido de Bouin
La solución de Bouin está formada por ácido pícrico, formaldehído y ácido acético glacial. Es una solución muy utilizada para el procesamiento de tejidos que se incluirán en parafina (ver capítulo de inclusión) y a cuyas secciones se le pueden aplicar un amplio espectro de tinciones. Es muy útil para tejidos blandos y embriones, y preserva bien el núcleo y el glucógeno. Hay que tener cuidado con el tiempo de fijación, que no debe exceder de 48 h en el caso de fijaciones por inmersión. Tras la fijación las muestras se pueden conservar en alcohol de 70°. No está recomendado para el riñón ni para el estudio de las mitocondrias. Antes de la inclusión en parafina es conveniente eliminar el ácido pícrico mediante lavados en alcohol de 70° porque impide una buena inclusión y hace que las tinciones no sean óptimas.
Solución de Clarke
Está solución está compuesta por etanol y ácido acético glacial (3:1). Fue una de las primeras soluciones fijadoras usadas, buena para muestras que se incluirán en parafina.
Carnoy
El Carnoy es un buen fijador para el glucógeno, para los hidratos de carbono simples y para las proteínas fibrosas. Es bueno para visualizar los ácidos nucleicos, aunque no la morfología nuclear, y destaca los grumos de Nissl del sistema nervioso. Puede producir retracciones tisulares. Está formado por etanol absoluto, cloroformo y ácido acético glacial.
Mezclas con formaldehído
El formaldehído es quizá el fijador más usado hoy en día, tanto para técnicas histológicas comunes como para otras como la inmunocitoquímica o la hibridación de ácidos nucleicos. Lo más frecuente es utilizarlo en solución al 4 % junto con otros fijadores. Se suele disolver en soluciones tamponadas que tienen una osmolaridad similar a la del tejido que se pretende fijar. Para fijaciones de tejidos destinados a microscopía electrónica se suelen utilizar soluciones fijadoras que contienen formaldehído y glutaraldehído. La función del formaldehído es iniciar una fijación rápida, por su mayor capacidad de penetración, mientras que el glutaraldehído realizará una fijación más poderosa, pero más lenta que no afectará a la estructura tisular puesto que el formaldehído ya ha realizado una fijación previa. Ejemplos de soluciones con formaldehído son formaldehído tamponado con áciod pícrico, Bouin, FAA (formaldehído, ácido ácetico, etanol), PLP (paraformaldehído, lisina y ácido peryódico).
Glutaraldehído-tetróxido de osmio
Los fijadores en combinación no tienen necesariamente que usarse al mismo tiempo. Es habitual que los tejidos destinados a microscopía electrónica sean inicialmente fijados en glutaraldehído (1 al 3 %) y paraformaldehído (2 al 4 %), para posteriormente ser postfijados en tetróxido de osmio al 1 % en solución tamponada. Este último es un buen preservador de la ultraestructura celular, sobre todo de las membranas, en cooperación con los aldheídos. Esto es importante porque el proceso para microscopía electrónica supone incubar el tejido en solventes orgánicos y polimerización de resinas a 60 °C, durante las cuales el tejido debe ser preservado.
 Métodos de fijación
Métodos de fijación 